Srdeční selhání je sice selhání „pumpy“, toto selhání pumpy vede v těle k celé řadě dalších pochodů, které nejsou na první pohled zřejmé.
Tělo pacienta se srdečním selháním produkuje celou řadu látek a hormonů jinak, než tělo zdravého člověka.
Je po podobné, jako by porucha motoru v autě vedla k větší tvorbě vody do ostřikovače, rychlejšímu opotřebení sedaček a také k poruchám spojky.
U srdečního selhání s omezenou ejekční frakcí dochází k omezení srdečního výdeje, což vede k omezenému prokrvení životně důležitých orgánů. Na tento stav ohrožení reaguje organismus několika způsoby:
1. dochází k aktivaci sympatického nervového systému. Tento název označuje aktivaci části nervového systému, které se říká sympatikus. K aktivaci sympatiku dochází při různých ohroženích organismu, například pokud se něčeho lekneme nebo jsme ve stresu. Zrychlí se tepová frekvence, dýchání, zvýší se krevní tlak, sníží se prokrvení orgánů, které nejsou nezbytně nutné pro přežití. Tato reakce vznikla během vývoje člověka k tomu, aby se organismus lépe vyrovnal s náhle vzniklým ohrožením (v minulosti typicky napadení predátorem). Činnost sympatiku je možné také ve zkratce charakterizovat jako boj nebo útěk (fight of flight). Cílem aktivace sympatiku u srdečního selhání je zvýšit srdeční stažlivost a tepovou frekvenci a zlepšit tak prokrvení tkání.
2. dochází k celé řadě hormonálních změn, aktivuje se osa renin-angiotenzin-aldosteron. Tento složitý systém hormonálních změn vede ke zvýšenému vyplavování mnoha látek, které upravují hospodaření těla s vodou a ionty. Tyto změny jsou prospěšné v krátkodobém horizontu, dlouhodobě je ale aktivace jak sympatického systému, tak systému renin-angiotenzin-aldosteron škodlivá. Vede k dalšímu poškození selhávajícího srdce, k zadržování sodíku a vody a provokuje poruchy srdečního rytmu.
3. Jedním z důsledků srdečního selhání je i sklon zadržovat v těle vodu. Ve fyziologii svalového stahu (jak pro běžné kosterní svaly, tak pro srdeční sval) platí tzv. Frank-Starlingův mechanismus. Tento velmi složitě vypadající název říká ve skutečnosti jen to, že síla svalového stahu je větší, pokud se sval před svým stahem více natáhne. Svaly (i srdce) můžeme tedy přirovnat k pružině- čím více jí roztáhneme, tím více se následně stáhne.
Čím více se tedy buňky srdečního svalu v povolovací fázi (diastole) natáhnou, tím silnější stah dokážou vyvinout. V případě srdce se natažení buněk srdečního svalu reguluje pomocí množství tekutiny v krevním řečišti. Čím je v krevním řečišti více tekutiny (krve), tím dojde k většímu roztažení srdečního svalu a tím silněji se srdce stáhne. U srdečního selhání tedy selhávající srdce vyšle signály, aby tělo začalo zadržovat vodu.
Také tento mechanismus vede krátkodobě ke zvýšení síly srdečního stahu, v dlouhodobém časovém horizontu ale dojde k zavodnění a následně k přechodu z chronického do akutního srdečního selhání (k dekompenzaci).
U srdečního selhání ale také dochází k celé řadě méně nápadných změn:
1. Aktivace zánětu. Ačkoli to na první pohled nevypadá, u pacientů zejména v pokročilejším stádiu srdečního selhání dochází k podobným změnám, jako u zánětu. I tato mírná aktivace zánětlivých mechanismů je v dlouhodobém horizontu škodlivá.
2. Odumírání buněk srdečního svalu. Je prokázáno, že u srdečního selhání dochází ke zvýšenému odumírání buněk srdečního svalu k programované buněčné smrti (apoptóze).
3. Abnormální cyklus vápníku v srdeční buňce. Během srdečního stahu se pravidelně střídá fáze srdečního stahu (systola) a fáze srdečního povolení (diastola). V buňce srdečního svalu (kardiomyocytu) je přechod mezi systolou a diastolou řízen hladinou vápníkových iontů. V diastole je hladina vápníkových iontů velmi nízká. Elektrická aktivace kardiomyocytu vede k tomu, že se vápníkové ionty uskladněné ve vápníkových zásobárnách (sarkoplazmatickém retikulu) dostanou dovnitř buňky. Vápník uvolněný ze sarkoplazmatického retikula je nezbytný k tomu, aby mohlo dojít ke vzájemnému posunu speciálních bílkovin ‒ myozinu (na obrázku modře) a aktinu (na obrázku červeně, oba jsou uvnitř kardiomyocytu). Zasunutím speciálních „hlavic“ myozinu do aktinu (podobně jako bychom zasunuli prsty proti sobě) dojde ke zkrácení základní stavební jednotky srdečních buněk (sarkomery), což v konečném důsledku vede k srdečnímu stahu.
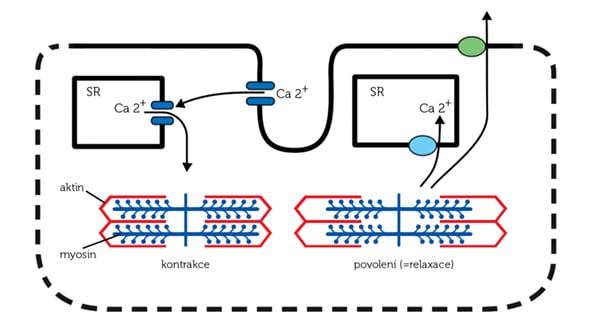
Obr. Sx. Role vápníku pro srdeční stah
Je jasné, že po srdečním stahu se musí uvést věci do původního stavu. Musí dojít k rozpojení molekul aktinu a myozinu a k přečerpání uvolněného vápníku. Část vápníku je přečerpána zpět do sarkoplazmatického retikula, část naopak ven z buňky. Tento proces je ale při srdečním selhání narušen, což vede k celé řadě nepříznivých důsledků. Vyšší hladina vápníku během srdečního povolení (diastoly) vede ke zvýšené tuhosti myokardu a dochází k také elektrické nestabilitě myokardu s větší pohotovostí ke vzniku arytmií.
3. Zvýšená tvorba vaziva v srdečním svalu. Aktivace systému renin-angiotenzin-aldosteron ale i jiné procesy vedou k tomu, že v selhávajícím srdci dochází ke zvýšené tvorbě vaziva (fibróze). Fibróza činí srdce tužším, dále také zhoršuje vedení elektrického vzruchu v srdci a způsobuje vyšší pohotovost k arytmiím.
4. Zvýšená tvorba vaziva v srdečním svalu. Aktivace systému renin-angiotenzin-aldosteron ale i jiné procesy vedou k tomu, že v selhávajícím srdci dochází ke zvýšené tvorbě vaziva (fibróze). Fibróza činí srdce tužším, dále také zhoršuje vedení elektrického vzruchu v srdci a způsobuje vyšší pohotovost k arytmiím.
5. Abnormality mitochondrií. Mitochondrie jsou malé struktury uvnitř skoro všech buněk v těle (kromě např. červených krvinek), jejichž úkolem je vyrábět pro buňky energii. Je prokázáno, že v důsledku srdečního selhání dochází rovněž k narušení funkce mitochondrií, čímž se zhoršuje výroba energie, která je pro správnou funkci srdce nezbytná.
3. Zvýšené napětí srdeční stěny. Během průběhu srdečního selhání dochází ke změně tvaru levé komory, původně malá a elipsovitá levá srdeční komora se zvětšuje a stává se více kulatou, dochází k její remodelaci. Jak se ale komora stává větší a více kulatou, dochází ke zvýšenému napětí srdeční stěny (Laplaceův zákon). Zvýšené napětí srdeční stěny ale vede ke zvýšeným požadavkům na dodávku kyslíku, což je u srdečního selhání z mnoha důvodů problém.
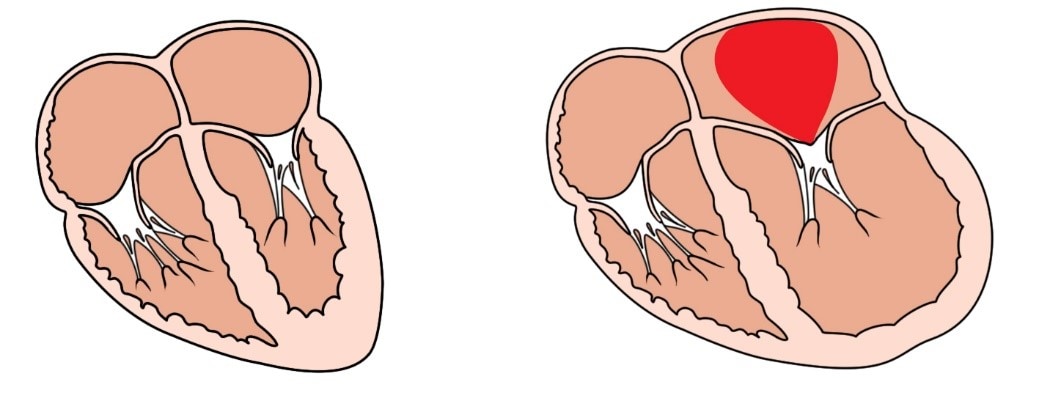
Obr. S5. Srdeční remodelace
U srdečního selhání tak dochází ke vzniku pozitivní zpětné vazby, kdy procesy, které jsou srdečním selháním vyvolané, ho dále ještě zhoršují.
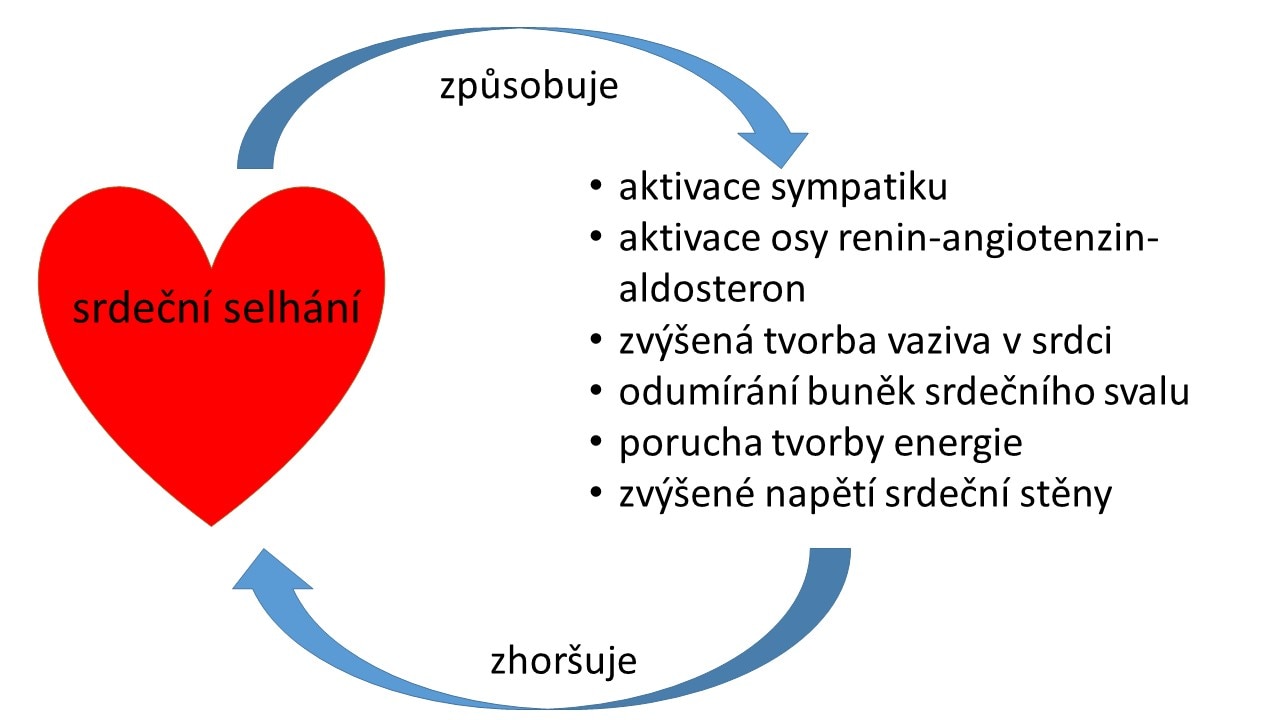
Obr. S6. Pozitivní zpětná vazba u srdečního selhání
Ne všechny změny u srdečního selhání jsou ale negativní. Srdce má rovněž mechanismy, které se alespoň částečně snaží výše uvedené škodlivé procesy kompenzovat. Zásadním kompenzačním mechanismem je aktivace tvorby natriuretických peptidů. Ačkoli hlavní funkcí srdce je pumpovat krev, působí také jako endokrinní orgán- vyplavuje do oběhu celou řadu látek. Natriuretické peptidy jsou látky bílkovinné povahy, které se tvoří v srdečních síních a komorách jako odpověď na zvýšené napětí srdeční stěny. V klinické praxi je nejpoužívanější B-natriuretický peptid (BNP).
Natriuretické peptidy mají celou řadu prospěšných účinků. Zvyšují průsvit cév (mají vazodilatační účinek), zvyšují vylučování sodíku z organismu a celkově tvorbu moči a snižují nadměrnou aktivitu sympatiku. Dále brání zbytňování srdce (hypertrofii) a hromadění vaziva v srdci (fibróze). Natriuretické peptidy se používají jednak pro stanovení diagnózy srdečního selhání, jednak mají svou roli při léčbě.
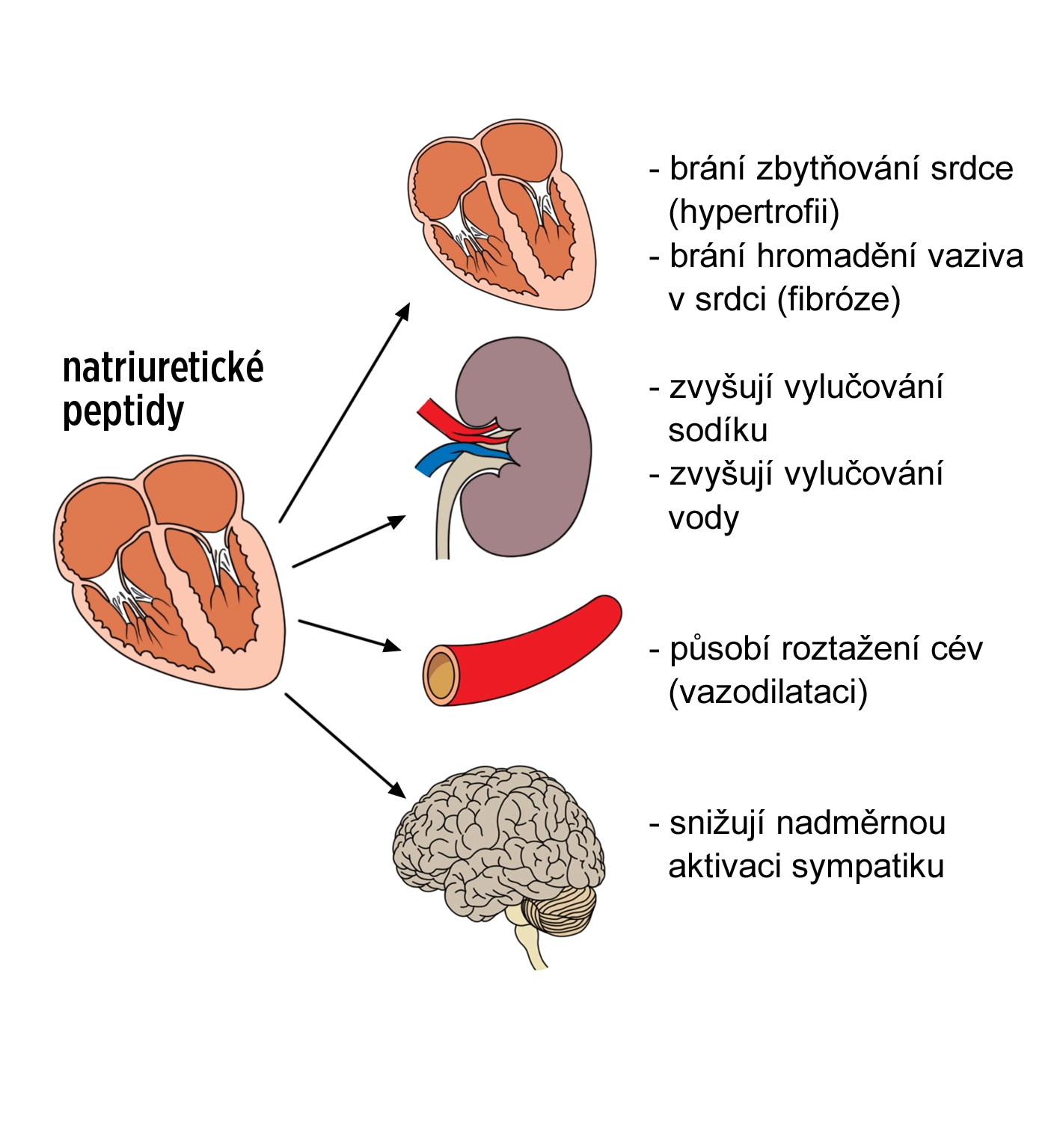
Obr. S7. Efekt natriuretických peptidů

